Extrait de l'introduction à la troisième édition anglaise, par C. Jinarajadasa.
Cet ouvrage contient les comptes rendus des recherches
par clairvoyance effectuées sur la structure de la matière. Ces observations
se sont étalées sur une période d’environ quarante
ans, les premières remontant à août 1895 et les dernières à octobre
1933. Les deux chercheurs, Annie Besant (1847-1933) et C.W. Leadbeater (1847-1934), étaient
des clairvoyants entraînés, bien équipés pour
contrôler et compléter leurs travaux respectifs.
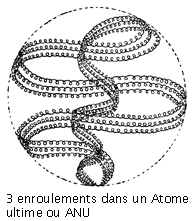
Méthode d’investigation : Cette méthode est unique et difficile à expliquer. Tout le monde connaît le mot « clairvoyance » (de voir clair), connotant une perception d’images et de sons non captés par les gens ordinaires. En Inde, le mot yoga désigne parfois des facultés dépassant les perceptions ordinaires. Dans le yoga de l’Inde, on stipule que celui qui s’entraîne « peut se rendre infinitésimal à volonté ». Cela ne signifie pas qu’il subit une diminution de la taille de son corps, mais seulement que la conception qu’il a de lui-même peut être minimisée à un point tel qu’en comparaison, les objets normalement petits lui paraissent grands. Les deux chercheurs avaient été entraînés par leurs gourous ou instructeurs orientaux à exercer cette faculté du yoga hors du commun, si bien que lorsqu’ils observaient l’atome d’un composant chimique, il leur apparaissait très agrandi.
Lorsqu’il utilise cette méthode, le chercheur est conscient, et non dans une transe quelconque. Il emploie ses facultés ordinaires pour enregistrer ce qu’il observe ; il dessine sur une feuille de papier un croquis de ce qu’il voit, et est à même de décrire ses impressions, que l’on peut transcrire en sténo. De même qu’un observateur au microscope peut décrire ce qu’il observe sans quitter de l’œil l’opercule afin qu’on l’enregistre, le chercheur clairvoyant qui observe un atome ou une molécule peut décrire la vision à laquelle il est confronté. Ce qu’il voit n’est pas subjectif, au sens d’une création de l’imagination, mais aussi objectif que le papier et le crayon que j’utilise pour écrire ceci.
L’objet observé, qu’il s’agisse d’un atome ou d’un composé, est vu exactement tel qu’il existe normalement, il n’est soumis à aucune tension produite par un champ électrique ou magnétique. Comme chaque élément se meut rapidement, la seule énergie mise à contribution est une certaine forme de volonté, susceptible de ralentir suffisamment ses mouvements pour permettre d’observer les détails.
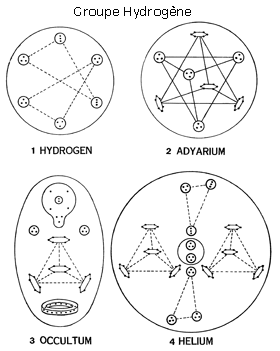
Les premières recherches furent effectuées en Angleterre, en 1895. Les premiers atomes observés furent ceux de quatre gaz existant dans l’air, l’hydrogène, l’oxygène, l’azote, et un quatrième (de poids atomique 3) non encore découvert par les chimistes. Les atomes ne portent pas d’étiquette, aussi le premier problème rencontré fut-il celui de leur identification. Le plus actif de ces quatre gaz fut celui que les chercheurs considéraient comme étant vraisemblablement de l’oxygène. Un gaz quelque peu léthargique était pris pour de l’azote. Le plus léger des quatre passait pour de l’hydrogène. Mais cette identification ne prit fin qu’après un examen des plus minutieux des constituants de chaque gaz (chaque soi-disant « atome », « in-sécable » par définition, étant en fait composé de constituants plus petits). L’hydrogène se révéla constitué de 18 unités, l’azote, de 261, l’oxygène, de 290, et le quatrième gaz, de 54. Au poids de l’hydrogène, comprenant 18 unités, on convint d’assigner le poids atomique 1 (un), et le nombre d’unités de l’oxygène et de l’azote fut divisé par 18. Les résultats concordèrent assez exactement avec les poids atomiques donnés dans les manuels, et les gaz purent ainsi être identifiés comme étant de l’hydrogène, de l’azote et de l’oxygène. Le deutérium excepté, on n’a jamais observé que des atomes de ces éléments puissent se mouvoir par paires. Le quatrième gaz, de poids atomique 3, fut pris pour de l’hélium, dont il était beaucoup question dans les journaux en 1894, à la suite de sa découverte par Rainsay. Ce ne fut que lorsqu’on finit par annoncer que le poids atomique de l’hélium était 4 que l’on compris que le gaz de poids atomique 3 s’en différenciait manifestement. On lui donna par la suite le nom d’occultum.
Les schémas et descriptions détaillés de la structure interne des atomes d’hydrogène, d’oxygène et d’azote, ainsi que des atomes ultimes, ou anu, dont chacun des éléments se compose, furent d’abord publiés à Londres dans Lucifer, en novembre 1895.
Lorsque l’élément à examiner existait à l’état pur et pouvait être obtenu facilement, comme pour le soufre, le fer et le mercure, son identification ne posait pas de problème, même en l’absence de dessin. On rencontra cependant une difficulté dans le cas du lithium et d’autres éléments. Une demande de spécimen de ces éléments fut adressée à Sir William Crooks, ami des deux chercheurs et membre de la Société Théosophique depuis plusieurs années. Le 18 juillet 1907, il répondit à un ami commun à Londres qui l’avait contacté que « les exigences de Leadbeater sont énormes. De la liste qu’il m’a envoyée, je puis lui donner la forme métallique du lithium, du chrome, du sélénium, du titane, du vanadium et du bore. Je ne puis lui envoyer le béryllium qu’à l’état d’oxyde. Mais il m’est presque impossible d’obtenir du scandium, du gallium, du rubidium et du germanium, si ce n’est peut-être sous une forme très impure ».
Les chercheurs découvrirent ensuite qu’il n’était pas essentiel que les recherches s’effectuent sur un élément non mélangé ou combiné à un autre. Dans de nombreux composés, les atomes qui les constituent ne sont pas juxtaposés, mais gardent chacun leur individualité atomique, comme le veut la théorie de la chimie. Chaque atome se disperse en unités plus petites et joint ses parties à d’autres dispersions similaires d’un ou de plusieurs autres atomes, à la manière des doigts des deux mains, capables de s’entrecroiser. Dans le sel, le sodium et le chlore forment un cube en se mélangeant. Par l’exercice de la volonté, la force de cohésion regroupant les constituants en une molécule peut être annulée; et dans ce cas, les parties de l’atome qui s’en étaient séparées sont instantanément rassemblées, ce qui lui redonne la forme qu’il avait avant de se combiner. Ainsi, lorsqu’on « brisait » une molécule de sel, les parties de sodium se regroupaient, formant un atome de sodium, et les éléments de chlore faisaient de même pour former un atome de chlore.
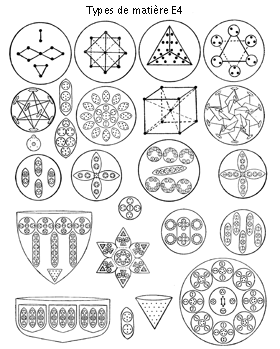
A mesure que les recherches avançaient, de nombreux atomes furent examinés. Les deux chercheurs passaient des vacances d’été à Weisser-Hirsch, près de Dresde, en Allemagne. Ma tâche consistait à enregistrer et à dessiner des schémas des éléments, tels qu’ils étaient décrits. A Dresde, il y avait un excellent musée, comprenant une partie réservée aux minéraux. Je dressai une liste des éléments recherchés tels qu’ils existaient à l’état combiné ; ce qui était possible en consultant une encyclopédie. Je me rendis au musée de Dresde avec cette liste, et je notai dans quelles vitrines les éléments requis se trouvaient à l’état combiné. Peu après mon retour, C.W. Leadbeater et moi nous rendîmes à Dresde, et je lui montrai les minéraux que j’avais notés. Il les examina rapidement et obtint l’image de la configuration complexe du minéral dans lequel se trouvait l’élément dont il avait besoin. Une fois revenu à Weisser-Hirsch, il fut à même de reproduire à volonté par clairvoyance la vision qu’il avait eue à Dresde. Exerçant alors son pouvoir de volonté sur la molécule d’un minéral, il dissolvait sa structure complexe. Ce faisant, les éléments de l’atome qui s’en étaient séparés se regroupaient et reformaient une unité individualisée. Ainsi, il était confronté à l’élément pur qu’il désirait, et pouvait l’observer et le dessiner. Lorsque un élément était configuré et dessiné, son schéma brut m’était confié afin que je dessine avec soin ses parties principales (jusqu’à obtention finale d’un bloc en demi-teinte), afin d’en dénombrer les constituants, diviser leur nombre par 18 (nombre d’éléments de l’hydrogène), et pouvoir comparer nos poids avec ceux indiqués dans les manuels de chimie les plus récents.
Au cours des investigations à Weisser-Hirsch en 1907, je dessinai 59 éléments (sans compter plusieurs isotopes observés). Ils furent publiés chaque mois dans la revue The Theosophist, paraissant à Adyar, un faubourg de Madras, à partir de janvier 1908.
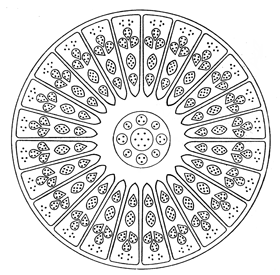
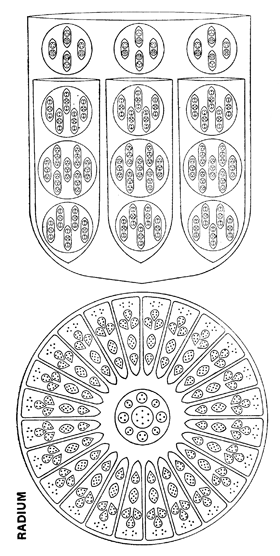
En 1907, trois éléments non enregistrés furent décrits, auxquels on donna provisoirement les noms d’occultum, de kalon et de platine B, de même qu’un groupe de trois éléments interpériodiques, étiquetés X, Y et Z. A Adyar on procéda en 1908 à des observations sur le radium à l’aide d’un schéma. Ce schéma me fut envoyé alors que je résidais aux Etats-Unis, et c’est là que j’exécutai le schéma qui parut dans The Theosophist en décembre 1908.
Les schémas de tous ces éléments furent dessinés par moi et parurent dans la première édition de La Chimie Occulte publiée en 1909, qui contenait aussi l’article sur L’Ether de l’Espace.
En 1909, l’ouvrage fut remanié par M. Leadbeater au Quartier Général de la Société Théosophique d’Adyar, près de Madras. Vingt autres éléments furent étudiés. On en fit les esquisses, sans toutefois les publier, bien qu’une description générale en fût donnée dans le numéro de juillet 1909 du Theosophist. Trois autres éléments non archivés et un isotope du mercure y sont décrits.
En 1919, à Sydney, en Australie, on procéda à des recherches sur les premiers composés, le sel et l’eau, et on en élabora les modèles très grossiers.
Une seconde édition de La Chimie Occulte fut publiée en 1919 ; celle-ci ne contenait cependant aucun supplément et ne rendait compte d’aucuns travaux postérieurs à 1907. M. A.P. Sinnett, qui fit paraître cette seconde édition, n’en rédigea que l’introduction.
En 1922, l’ouvrage fut à nouveau remanié à Sydney
et des descriptions des composés furent communiquées pour la
première fois. L’eau et le sel avaient été examinés
en 1919, mais leurs schémas n’avaient pas été faits,
et plusieurs autres observations de composés furent effectuées
et toutes publiées dans The Theosophist en
mars, avril et août
1924, en mars, avril, août, septembre et octobre 1925, et en juillet
1926. Certains composés du carbone avec des chaînes aliphatiques
et aromatiques se trouvaient parmi les produits examinés. On fit des
recherches sur une structure complexe, le diamant, composé de 594
atomes de carbones. Un modèle élaboré à Sydney
me fut envoyé en Inde. Une description de cette structure et une photographie
du modèle parut dans The Theosophist en
septembre 1925. Le hafnium fut décrit en 1928 et le rhénium en 1931.
...